
- Muallif Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Oxirgi o'zgartirilgan 2025-01-22 17:12.
To'qnashuv nazariyasi , nazariya stavkalarini bashorat qilish uchun ishlatiladi kimyoviy reaksiyalar , ayniqsa gazlar uchun. The to'qnashuv nazariyasi a uchun degan taxminga asoslanadi reaktsiya sodir bo'lishi uchun reaksiyaga kirishuvchi turlarning (atomlar yoki molekulalarning) birlashishi kerak yoki to'qnashmoq bir-biri bilan.
Bundan tashqari, to'qnashuv nazariyasining 3 qismi nima?
Lar bor uch muhim qismlar uchun to'qnashuv nazariyasi , reaksiyaga kirishuvchi moddalar kerak to'qnashmoq , ular kerak to'qnashmoq etarli energiya bilan va ular kerak to'qnashmoq to'g'ri yo'nalish bilan.
Bundan tashqari, siz to'qnashuv nazariyasini qanday qilasiz? Qachonki katalizator ishtirok etsa to'qnashuv reaktiv molekulalar o'rtasida kimyoviy o'zgarish uchun kamroq energiya talab qilinadi olish joy, va shuning uchun ko'proq to'qnashuvlar reaktsiya sodir bo'lishi uchun etarli energiyaga ega. Shunday qilib, reaktsiya tezligi oshadi. To'qnashuv nazariyasi kimyoviy kinetika bilan chambarchas bog'liq.
To'qnashuv nazariyasi kimyoviy reaksiya tezligini qanday tushuntiradi?
The to'qnashuv nazariyasi shunday deydi kimyoviy reaksiya faqat mavjud bo'lganda paydo bo'ladi to'qnashuvlar molekulalar va atomlar orasidagi to'g'ri energiya darajasi. Bundan kelib chiqadiki, agar molekulalar to'qnashmoq tez-tez bu oshadi darajasi ning reaktsiya . Harorat qanchalik yuqori bo'lsa, molekulalar va atomlarning kinetik energiyasi shunchalik ko'p bo'ladi.
Kimyoda muvaffaqiyatli to'qnashuv nima?
Molekulalar kerak to'qnashmoq faollashtirish energiyasi deb ataladigan etarli energiya bilan, shuning uchun kimyoviy aloqalar uzilishi mumkin. Molekulalar kerak to'qnashmoq to'g'ri yo'naltirish bilan. A to'qnashuv bu ikki mezonga javob beradi va natijada a kimyoviy reaksiya sifatida tanilgan muvaffaqiyatli to'qnashuv yoki an samarali to'qnashuv.
Tavsiya:
Kimyoviy atom nazariyasi nima?

Kimyo va fizikada atom nazariyasi materiya tabiatining ilmiy nazariyasi boʻlib, u modda atomlar deb ataladigan diskret birliklardan tashkil topganligini taʼkidlaydi. 19-asr kimyogarlari bu atamani qaytarilmas kimyoviy elementlar sonining ortib borishi munosabati bilan ishlata boshladilar
Reaksiya tezligining to‘qnashuv nazariyasi amal qilishi uchun quyidagilardan qaysi biri bajarilishi kerak?

Reaksiya tezligining to‘qnashuv nazariyasi amal qilishi uchun quyidagilardan qaysi biri bajarilishi kerak? - Reaksiyaga kirishuvchi molekulalar bir-biri bilan to'qnashishi kerak. - Molekulalar atomlarning qayta joylashishiga olib kelishi mumkin bo'lgan yo'nalishda to'qnashishi kerak. -Reaksiya qiluvchi molekulalar yetarli energiya bilan to'qnashishi kerak
Elektr tokining kimyoviy ta'siri qanday, kimyoviy ta'sirga misol keltiring?

Elektr tokidagi kimyoviy ta'sirning umumiy misoli elektrokaplamadir. Bu jarayonda elektr toki o'tadigan suyuqlik mavjud. bu elektr tokidagi kimyoviy ta'sirlarning misollaridan biridir
Kimyoviy belgilar va kimyoviy formulalar nima?
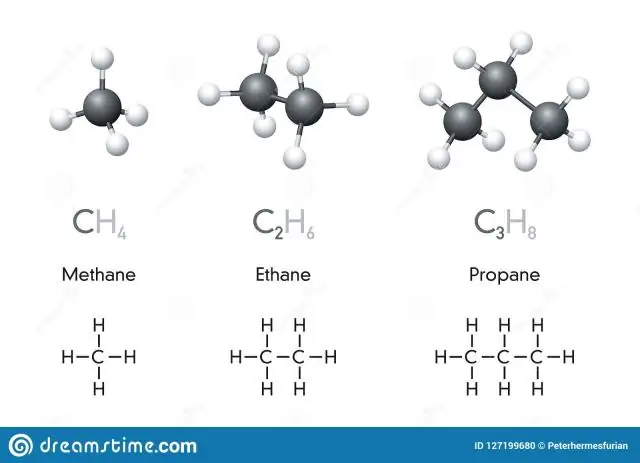
Kimyoviy belgi - bu elementning bir yoki ikki harfli belgisi. Murakkablar ikki yoki undan ortiq elementlarning birikmasidir. Kimyoviy formula - bu birikma tarkibidagi elementlarni va bu elementlarning nisbiy nisbatlarini ko'rsatadigan ifoda. Ko'pgina elementlarda elementning lotincha nomidan kelib chiqqan belgilar mavjud
Kalvin siklidagi reaksiyalarning to'g'ri tartibi qanday?

Kartochkalar Davra 1. Fotosintezning yorug'lik reaktsiyalari uchun nima kerak emas? Ta'rif Karbonat angidrid atamasi 19. Kalvin-Benson siklidagi reaksiyalarning to'g'ri tartibi qanday? Ta'rif c. uglerod fiksatsiyasi, G3P sintezi, RuBP ning regeneratsiyasi
