
- Muallif Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Oxirgi o'zgartirilgan 2025-06-01 05:06.
A hosil qilish uchun bir xil A va B komponentlarini hisobga olgan holda yo'q - ideal yechim , bu bo'ladi salbiy ko'rsatish Raul qonunidan chetga chiqish faqat qachon: erigan va erituvchi o'zaro ta'siri hisoblanadi erigan-erigan va erituvchi-erituvchi o'zaro ta'siridan kuchliroqdir hisoblanadi , A - B > A - A yoki B - B.
Shu tarzda, Raul qonunidan ijobiy chetga chiqishga nima sabab bo'ladi?
Agar erigan modda va erituvchi o'zlari kabi bir-biri bilan chambarchas bog'lanmagan bo'lsa, u holda eritma Raul qonunidan ijobiy og'ish chunki erituvchi molekulalari eritmadan gaz fazasiga o'tishni osonlashtiradi.
Keyinchalik savol tug'iladi: Xloroform va aseton aralashmasida qanday ideal bo'lmagan og'ishlar ko'rsatilgan ideal va ideal bo'lmagan yechim nima? Javob: Xloroform va aseton aralashmasi ko'rsatish -ve og'ish Raul qonunidan. Ideal yechimlar ular yechimlar Har qanday harorat va konsentratsiyada Raul qonuniga bo'ysunadi ideal bo'lmagan echimlar turli konsentratsiya va haroratlarda Raul qonunidan chetga chiqadi.
Bu erda ideal yechim va ideal bo'lmagan yechim nima?
A yo'q - ideal yechim a yechim qoidalariga rioya qilmaydi ideal yechim bu erda molekulalar orasidagi o'zaro ta'sirlar turli komponentlarning molekulalari orasidagi o'zaro ta'sirga bir xil (yoki juda yaqin). Biz taxmin qilamiz ideal suyultirish xususiyatlari yechimlar.
Raul qonunidan musbat va manfiy chetlanish deganda nima tushuniladi?
Raul qonuni ma'lum bir haroratda uchuvchan bo'lmagan eritmani o'z ichiga olgan eritmaning bug 'bosimi erituvchining mol ulushiga to'g'ridan-to'g'ri proportsional ekanligini ta'kidlaydi. Ideal bo'lmagan echimlar ko'rsatiladi ijobiy & salbiy og'ishlar ideal xulq-atvordan.
Tavsiya:
Nima uchun molekulaning to'p va tayoq modeli haqiqiy bo'lmagan tasvirdir?
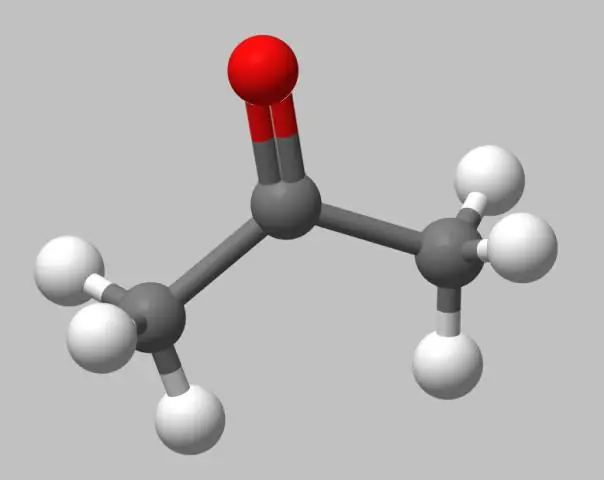
To'p va tayoq modellari. To'p va tayoq modellari bo'shliqni to'ldirish modellari kabi realistik emas, chunki atomlar van der Waals radiuslaridan kichikroq radiusli sharlar sifatida tasvirlangan. Biroq, bog'lanish tartibini ko'rish osonroq, chunki bog'lanishlar tayoq shaklida aniq ifodalangan
Ideal gaz tenglamasi nimadan kelib chiqadi?

Ushbu tenglamaning eng keng tarqalgan shakli PV= K va V/T =k bo'lgani uchun. PV/T = doimiy. Shunday qilib, Ideal gaz tenglamasi quyidagicha berilgan. PV = nRT. bu erda P= gaz bosimi; V=gazning hajmi; n = Mollar soni; T=Mutlaq harorat; R=Ideal gaz konstantasi, shuningdek Boltsman doimiysi sifatida ham tanilgan = 0,082057 L atm K-1 mol-1
Raul qonuni nima uchun muhim?

Raul qonunining ta'siri shundaki, eritmaning to'yingan bug 'bosimi har qanday haroratda sof erituvchidan past bo'ladi. Bu erituvchining fazaviy diagrammasiga muhim ta'sir ko'rsatadi
Nima uchun to'liq yonish to'liq bo'lmagan yonishdan ko'ra yaxshiroq?

To'liq bo'lmagan yonish havo yoki kislorod bilan ta'minlanmaganida sodir bo'ladi. Suv hali ham ishlab chiqariladi, ammo karbonat angidrid o'rniga uglerod oksidi va uglerod ishlab chiqariladi. Uglerod kuyik shaklida chiqariladi. Uglerod oksidi zaharli gazdir, shuning uchun to'liq yonish to'liq yonishdan ko'ra afzalroqdir
Matematikada bitta yechim nima?

Published on Nov 9, 2014. Siz tenglamaning bitta yechimi borligini (bir oʻzgaruvchi bitta raqamga teng boʻlganda) yoki uning yechimi yoʻqligini (tenglamaning ikki tomoni bir-biriga teng emas) aniqlashingiz mumkin boʻladi. yoki cheksiz yechimlar (tenglamaning ikki tomoni bir xil)
