
- Muallif Miles Stephen [email protected].
- Public 2023-12-15 23:41.
- Oxirgi o'zgartirilgan 2025-06-01 05:06.
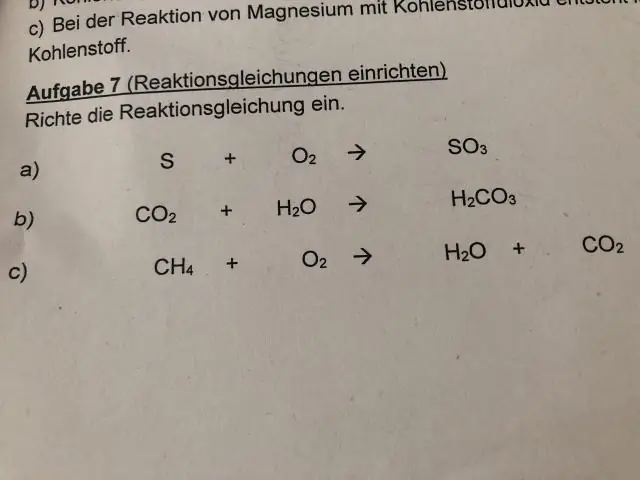
Umuman EAN markaziy metall ionining miqdori eng yaqin gazdagi elektronlar soniga teng bo'ladi. Agar EAN Markaziy metalning miqdori elektronlar soniga teng bo'lsa, eng yaqin nol gazda kompleks barqarorlikka ega. EAN = [Z metall - (ox. metallning holati) +2(metallning koordinatsion raqami)].
Buni hisobga olsak, EAN qoidasi nimani anglatadi?
…kuzatish, buyon ma'lum EAN qoidasi , bir qator metall komplekslarida metall atomi o'zini etarli ligandlar bilan o'rab olishga intiladi, natijada samarali atom raqami Bu metallning xuddi shu davrda topilgan asil gaz elementining atom raqamiga son jihatdan teng …
Xuddi shunday, misol bilan 18 elektron qoidasi nima? Bunda misol , molekulyar birikmaga ega 18 elektron soni, ya'ni uning barcha orbitallari to'ldirilgan va birikma barqaror. ni qondirish uchun 18 elektron qoida , [Co(CO)5]z birikma z = +1 zaryadga ega bo'lishi kerak.
Shuni ham bilish kerakki, samarali atom raqamini qanday topish mumkin?
Matematik jihatdan, samarali atom raqami Zeff "O'z-o'zidan mos keladigan maydon" hisoblari deb nomlanuvchi usullar yordamida hisoblanishi mumkin, ammo soddalashtirilgan holatlarda bu shunchaki qabul qilinadi. atom raqami minus raqam yadro va ko'rib chiqilayotgan elektron orasidagi elektronlar.
Qaysi biri EAN qoidasiga bo'ysunmaydi?
The EAN ( Samarali atom raqami ) hisoblanadi ko'pchilik karbonillar uchun amal qiladi. Biroq, V (CO) 6 kabi ba'zi karbonillar bunday qilma ga amal qiling EAN qoidasi . Markaziy metall atomi atrofidagi total elektronlar (V) hisoblanadi 23+12 = 35, qaysi emas har qanday asil gazni o'rab turgan elektronlar soniga teng, shuning uchun u hisoblanadi ning buzilishi EAN qoidasi.
Tavsiya:
BBC Bitesize kimyoda qanday yechim bor?

Eritma erigan modda, odatda eruvchan qattiq birikma erituvchi deb ataladigan suyuqlikda, odatda suvda eritilganda hosil bo'ladi
Kimyoda bog'lanishlar qanday ishlaydi?
Kimyoviy bog'lanish kimyoviy birikmalar hosil bo'lishini ta'minlaydigan atomlar, ionlar yoki molekulalar o'rtasidagi doimiy tortishishdir. Bog'lanish ion aloqalarida bo'lgani kabi qarama-qarshi zaryadlangan ionlar orasidagi elektrostatik tortishish kuchi yoki kovalent bog'lanishlarda bo'lgani kabi elektronlarni taqsimlash natijasida yuzaga kelishi mumkin
Kimyoda Aufbau printsipidan qanday foydalanasiz?

Aufbau printsipi elektronlarning atom yadrosi atrofidagi qobiq va pastki qavatlarga qanday joylashishini aniqlash uchun ishlatiladigan qoidalarni belgilaydi. Elektronlar eng past energiyaga ega bo'lgan pastki qavatga kiradi. Orbital Pauli istisno printsipiga bo'ysunadigan ko'pi bilan 2 ta elektronni ushlab turishi mumkin
Kimyoda neytronning ta'rifi qanday?

Neytron - bu atomlar yadrosida joylashgan subatomik zarracha bo'lib, u atom yadrosidagi boshqa subatomik zarralardan (protonlar deb ataladi) farq qiladi, chunki neytronlarda (nol) zaryad yo'q, har bir proton esa +1 musbat zaryadga ega
Kimyoda entalpiya o'zgarishini qanday hisoblash mumkin?

Yechish uchun ∆H = m x s x ∆T formulasidan foydalaning. Agar sizda m, reaktivlaringizning massasi, s, mahsulotingizning o'ziga xos issiqligi va ∆T, reaktsiyangizdan harorat o'zgarishi bo'lsa, siz reaktsiya entalpiyasini topishga tayyor bo'lasiz. Qiymatlaringizni ∆H = m x s x ∆T formulasiga kiriting va yechish uchun koʻpaytiring
